新药临床试验要多久
新药临床试验要多久
新药研发是一个漫长而复杂的过程,涉及多个阶段和步骤,从临床前研究到临床试验,再到上市,整个过程需要花费大量的时间和资源,单从时间轴来临床试验看大概需要7-14年左右,其中研发阶段一般是2-3年左右,临床前实验一般是2-4年左右,临床试验一般是3-7年左右。
一、临床前研究
1.药物研发(一般2-3年)
在实验室研究中,科学家们寻找治疗特定疾病的具有潜力的新化合物;这一阶段包括药物靶点的发现及确认、化合物的筛选与合成以及活性化合物的验证与优化。
2.临床前实验(一般2-4年)
这一阶段的目的是评估药物的药理和毒理作用,以及药物的吸收、分布、代谢和排泄情况(ADME);此外,还需要进行生产工艺、质量控制、稳定性等研究(CMC);这个阶段的实验需要在动物层面展开,以确定药物的有效性与安全性。
二、临床试验审批Investigational New Drug(IND)
在临床试验开始之前,需要向相关药品监管机构提交IND申请,监管机构将评估试验的安全性和科学性,一定要获得国家主管部门的批准,才可以进行临床试验。
三、临床试验(一般3-7年)
Ⅰ期临床(20-100例,正常人,安全性评价)
Ⅰ期临床试验是在正常人群中进行的,主要目的是评估药物的安全性;这个阶段的试验通常涉及20-100例受试者,通过监测药物的副作用和代谢情况,来确定药物的安全剂量范围。
Ⅱ期临床(100-300例,病人,有效性评价)
Ⅱ期临床试验是在病人群体中进行的,主要目的是评估药物的疗效;这个阶段的试验通常涉及100-300例受试者,通过监测药物的疗效和副作用,来确定药物的剂量和治疗方案。
Ⅲ期临床(300-5000例,病人,扩大样本量,进一步评价)
Ⅲ期临床试验是在更大的病人群体中进行的,主要目的是进一步评估药物的疗效和安全性;这个阶段的试验通常涉及300-5000例受试者,通过监测药物的疗效和副作用,来确定药物的最终批准和上市。
四、新药上市申请
在完成临床试验并取得阳性结果后,药品研发企业需向药品监管机构提交新药上市申请,监管机构将对申请进行审查,包括对临床试验数据的评估,一旦批准,新药即可上市销售。
综上所述,新药从临床试验到上市需要的时间因药物种类、研发过程中的困难以及监管机构的审查时间而异,一般来说,新药研发从临床三期到上市大约需要7-14年的时间。
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

2024年11月8日FDA批准第7款CA
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
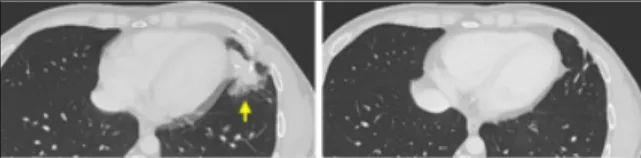
3名晚期肠癌患者肿瘤消退!《自然医学》重
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
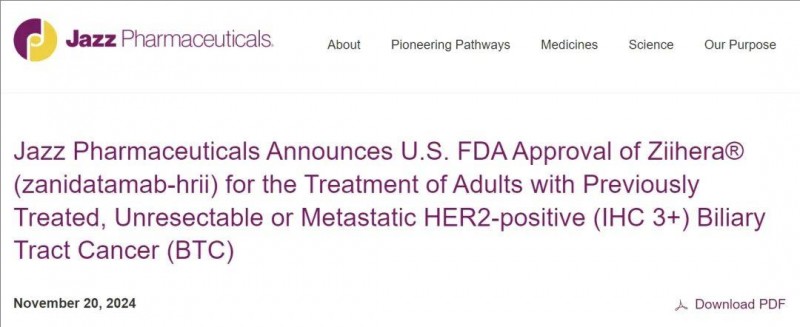
HER2历史性突破:首个HER2双表位双
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
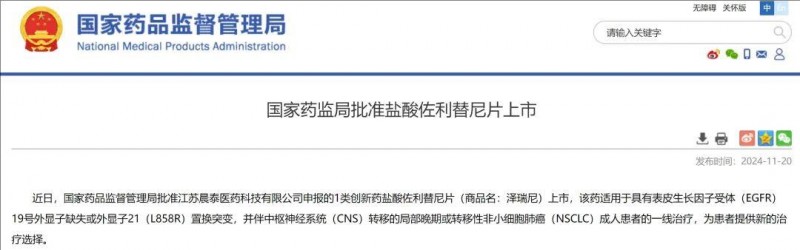
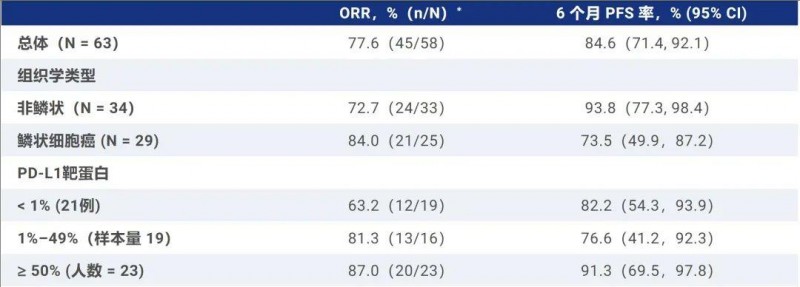
无进展生存翻倍!肺癌脑转移有救了,佐利替
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
2024速看!27类重磅抗癌药纳入优先评
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
两次CAR-T细胞回输,美国首位晚期胃癌
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




